Развивающие игры на уроках химии
(методическое пособие)
Макарова Е.Р., к.пед.наук,
доцент кафедры педагогики
и психологии
Главная тенденция, наметившаяся сегодня в среднем образовании - поворот к личности школьника, внимание к его внутреннему миру, возможностям, склонностям, интересам.
В этой связи, в учебно-воспитательном процессе приоритет отдается приемам опосредованного педагогического воздействия, когда вместо “жестких методов, излишнего дидактизма и назидательности”, на первый план выдвигаются разнообразная творческая деятельность, активное общение учителя с учеником, совместный поиск решений. Именно эти условия обеспечивают, как показывает школьная практика наилучшие возможности для превращения ученика в субъекта учебной деятельности, сознательно и активно овладевающего знаниями, учебными умениями и навыками.
Потребностью реализовать такую серьезную перестройку учебно-воспитательного процесса и объясняется усилившееся в последнее время внимание ученых педагогов и учителей практиков к игре как методу обучения. Игру стали рассматривать как одно из эффективных направлений гуманизации и демократизации школьной жизни, как средство формирования эмоционально-волевой сферы школьника, развития его внимания, навыков коллективной деятельности и самостоятельного приобретения знаний.
Главным процессом деятельности ученика является учение - серьезный и напряженный труд, который заполняет каждодневную череду уроков. При этом мы, взрослые, порою забываем, что ученики приходят в школу не только для получения определенной совокупности знаний, умений и навыков. Они проживают сложный и динамичный период своей жизни - отрочество, юность, выступают в мир разнообразных человеческих отношений. По словам К.Д.Ушинского: “Дитя не только готовится к жизни, но уже живет”. И вся эта жизнь невозможна без игры и романтики, такова уже природа детства. Не только дошкольников, но и малышей-первоклашек, и подростков, и выпускников характеризует повышенная эмоциональность, стремление проверить, испытать свою силу и ловкость, желание фантазировать, открывать тайны и стремиться к чему-то трудному, далекому и прекрасному.
Чем же так привлекательна игра для ребенка? Конечно же, ребенку (ученику) приятно перевоплощаться и таким образом наглядно демонстрировать себе и товарищам уровень своего понимания взрослой жизни. Приятно переживать успех и одобрение товарищей по игре. Важным психологическим фактором, стимулирующим активность играющего ребенка, является то, что он избавляется от опеки взрослых, которая подчас становится для него обременительной.
Играя, ребенок совершает самостоятельные поступки и несет за них ответственность, определяемую лишь правилами игры и климатом, царящим в его школьном (классном) коллективе.
Игра среди детей способствует выявлению характеров, появлению лидеров. В ней - в игре - получают свое выражение такие качества личности, как целеустремленность, активность, динамичность, продуктивность мышления, прочность и оперативность памяти, стремление к постоянному совершенствованию и вера в собственные силы. Поэтому она с полным правом может рассматриваться не только как альтернатива серости и скуке в борьбе за самостоятельность детей, за создание мажорного климата школьного коллектива, но и как средство развития творческих задатков, воображения и фантазии детей, как комплексная сфера их жизнедеятельности, способная совместить труд, познание и искусство.
С дидактической точки зрения игровая форма обучения не противостоит традиционному типу обучения, не противоречит современным педагогическим теориям. Это подтверждается следующим. Игра оказывает позитивное влияние на школьника благодаря своему естественному воспитательному потенциалу. Это добровольный и спонтанный вид его деятельности. Чувство свободного выбора, которое сопровождает игровой процесс, доставляет ребенку удовольствие и радость. Деятельность, организованная на основе таких переживаний, мобилизует в ребенке все силы и помогает им лучшим образом проявляться. Уже из сказанного можно заключить, что использование в учебном процессе игровых форм обучения открывает значительные возможности для активизации познавательной деятельности учащихся.
В практике преподавания химии в массовой школе предпочтение отдается играм-упражнениям, тренировочным, настольным - типа: “Химическое лото”, “Химическое домино”, “Химические шашки”, “Историко-химическое лото”, “Третий лишний”, “Химическая эстафета”, “Найди свое поле” и т.д. Такие непродолжительные во времени игры, используют обычно в целях формирования умений: определять валентность химических элементов по формуле их соединений, составлять уравнения химических реакций, определять принадлежность вещества к соответствующему классу, пользоваться периодической системой химических элементов для характеристики строения атомов. Творчество учителя при проведении подобных игр проявляется достаточно широко: игры используют как средство дифференцированного контроля знаний, в ходе групповой и коллективной работы, при проведении уроков по обобщению знаний, зачетов, итоговых конференций и т.д.
При отборе игр прежде всего обращается внимание на то, в какой степени данная игра соответствует задачам обучения и воспитания, которые должны быть решены при изучении той или иной темы или на конкретном уроке. Исходя из этих позиций мы сформулировали один из главных принципов отбора дидактических игр по химии, который составил основу предлагаемого подхода к разработке и методике использования игр в учебно-воспитательном процессе - принцип единства содержательной и процессуальной сторон игры. Вместе с тем, нельзя не видеть того, что использование отдельно взятых дидактических игр мало эффективно. Именно это обстоятельство ставит вопрос о необходимости создания определенной системы дидактических игр.
Системность в использовании любого метода сама по себе способна обеспечить новое качество учебно-воспитательного процесса.
Как известно, в структуре школьного курса химии принято выделять три связанных между собой блока содержания: “Вещество”, “Химическая реакция”, “Познание и применение веществ человеком”. Каждый блок включает в себя определенные содержательные линии, расположенные в последовательности, выявляющие генетическую связь между ними.
Несмотря на специфику своего содержания, все три блока имеют вполне определенное сходство в структуре и логике их построения. Суть этого сходства в следующем: содержательные линии каждого из блоков пронизывают все ступени изучения химии - от пропедевтических курсов в начальной и основной школе (5-7 классы) до систематических курсов химии общеобразовательного уровня, изучаемых в 8-9 и 10-11 классах. Такая логика построения учебного материала предусматривает его постепенное углубление и усложнение. При этом в начале любого курса (или его отдельной темы) возникает необходимость введения некоторых новых понятий и терминов. Простое заучивание такого специфичного материала путем многократного его повторения безусловно скучно и непривлекательно для учащихся. И именно в подобных ситуациях игровые методы могут оказаться наиболее приемлемыми для поддержания необходимого уровня интереса учащихся в учении.
Ярким примером такого рода является использование игровых форм при изучении темы "Первоначальные химические понятия" (начало изучения курса в основной школе), когда учащиеся начинают делать первые шаги по овладению химическим языком, сложным и мало понятным для них. Согласно современной тенденции гуманитаризации образования желательно, чтобы введение названий, терминов и понятий, которые в целом ряде случаев заимствованы из различных иностранных языков, сопровождалось разъяснением этимологии слова и сами названия и термины запоминались учащимися осознанно. Это позволит, во-первых, предотвратить возможные искажения тех слов, которые далеко не всегда привычны для русского языка. Во-вторых рассмотрение происхождения того или иного термина или названия способствует повышению общей культуры учащихся, поскольку вводит их в атмосферу определенной исторической эпохи развития науки и цивилизации в целом.
Такие функции могут выполнить многие известные в преподавании химии игры, например, "Историко-химическое лото".
Таким образом, принципы единства содержательной и процессуальной сторон игры в сочетании с анализом структуры учебного материала курса химии позволяет сразу же выявить возможности использования отдельных игр. На этой основе было выявлено существенное различие в возможностях и методике использования настольных игр, с одной стороны, и более сложных видов игр (ролевых, деловых), с другой.
Разнообразные настольные игры целесообразно использовать на начальном этапе изучения курса (или какой-либо его темы). В этом случае они выступают как один из способов организации учебной деятельности, способствующих усвоению учащимися химической символики, первоначальных химических понятий и несложных практических умений. Настольные игры предусматривают использование учащимися известных им видов игровой деятельности для усвоения этого содержания курса химии. Благодаря этому они органично включаются в ход урока, подчинены его цели и занимают относительно небольшую часть учебного времени. В связи с широкой вариативностью этих игр как по форме, так и по содержанию, для усвоения одного и того же понятия могут быть использованы различные игры.
Ниже приводится перечень настольных игр, которые расположены в порядке усложнения видов деятельности, которую должны осуществлять учащиеся для выполнения заданий предлагаемых в ходе той или иной игры.
ПЕРЕЧЕНЬ НАСТОЛЬНЫХ ИГР
- Репродуктивная деятельность.
- Химическая азбука.
- Найди свое поле.
- Головоломка.
- Валентный лабиринт.
- Химический лабиринт.
- Химические мозаики.
- Репродуктивно-поисковая деятельность.
- Крестики-нолики.
- Пятый лишний.
- Химическое лото.
- Кроссворд.
- Химические шашки.
- Химическое домино.
- Химические кубики.
- Репродуктивно-исследовательская деятельность.
- Светофор.
- Составь трехзначное число.
В 8 классе в связи с тем, что значительный объем информации требует запоминания, большое количество игр направлено на репродукцию знаний. Большинство из игр, используемых в восьмом классе в связи с малым опытом игровой деятельности учащихся, представляют собой настольные игры, построенные на хорошо знакомой детям основе. Значительное количество часто применяемых небольших по объему мобильных дидактических игр дает детям навыки игровой деятельности и призвана подготовить учащихся к использованию более сложных типов игр.
Серия небольших игр, объединенных общей целью, составляет основу более сложной и длительной по времени дидактической игры - общественного смотра знаний. К такой же более сложной по форме игровой деятельности в восьмом классе, состоящей из отдельных игровых фрагментов, относится дидактическая игра “Путешествие по станциям”. Эти более сложные по организации и более длительные по времени игры своей задачей имеют обобщение и систематизацию знаний.
К концу третьей четверти в восьмом классе, в связи с накоплением у детей опыта игровой деятельности, целесообразно ввести в учебный процесс деловую игру. Такой игрой в конце третьей четверти в восьмом классе является деловая игра по теме “Обобщение сведений о важнейших классах неорганических соединений”.
В девятом классе использование настольных игр по частоте несколько уменьшается. Они используются в основном, при прохождении тем: “Теория электролитической диссоциации”, “Окислительно-восстановительные реакции”, “Скорость химической реакции. Химическое равновесие”, но большее значение приобретают деловые игры - длительные по времени, цель которых систематизация знаний и стимулирование творческого применения учащимися этих знаний.
В десятом классе возможно использование настольных игр, но накопленный опыт игровой деятельности позволяет шире использовать игры, которые способствуют не только достижению определенного уровня знаний, но и социализации личности.
Как мы уже отметили, каждая игра может быть охарактеризована с содержательной и процессуальной сторон, и что содержательную основу ее составляет тот учебный материал, который отобран для урока. При этом следует заметить, что одно и то же содержание может быть основой для проведения различных игр. Например, в нашем случае при изучении темы “Обобщение сведений о важнейших классах неорганических соединений” мы используем игру “Пятый лишний”, “Составь трехзначное число”, деловую игру, регламентированную дискуссию, “Путешествие по станциям”.
С другой стороны одна и та же игра может быть построена на различном материале. Например, настольная игра “Химический лабиринт” может быть использована для изучения состава веществ в курсе органической и неорганической химии.
Особенность настольных игр по химии состоит в наличии игрового правила, в котором внутренне заключена игровая задача. Настольные игры проводятся как индивидуально, так и в ходе групповой и коллективной работы. Они дают возможность дифференцированно подойти к оценке знаний и способностей учащихся.
Приведем пример настольной игры “Дидактические кубики”. Данная настольная игра может проводиться в конце урока после изучения новой темы или в начале последующих уроков для закрепления знаний и в качестве разминки.
Настольную игру “Дидактические кубики” мы используем при изучении тем: “Количество вещества. Моль. Молярная масса”, “Вычисление массовой доли и массы растворенного вещества” в восьмом классе, “Определение массовой (объемной) доли выхода продукта от теоретически возможного и определение массы вещества по выходу продукта” в девятом классе.
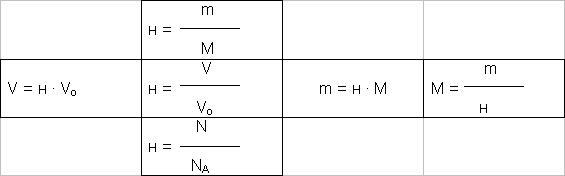
На каждой грани большого кубика (рисунок) изображены формулы, относящиеся к изучаемой теме. Ученик бросает кубик и записывает на доске выпавшую формулу, поясняет назначение и смысл каждой входящей в нее величины. Остальные учащиеся проверяют правильность выполненной работы и задают ему вопросы, в том числе предлагают осуществить некоторые расчеты по формуле. Важно при отборе содержания для этой дидактической игры предусмотреть не только повторение опорных знаний и умений, но и научить учащихся приемам умственных действий, которые будут необходимы далее при усвоении новых знаний (например, проведение прямых и обратных расчетов по формуле с соблюдением определенной последовательности действий). В большей мере этим целям служит игра "Пятый лишний", которая проводится при изучении темы "Обобщение сведений о важнейших классах неорганических соединений". В этом случае ее можно использовать в целях проверки знаний и закрепления умений и навыков по классификации неорганических веществ.
В данной игре задание выполняет один ученик, а присутствующие учащиеся - эксперты осуществляют контроль за выполнением задания или они играют роль консультантов. Играющему предлагается набор формул, в котором четыре принадлежат к одной систематической группе, а пятая - случайная. Ученик должен ее устранить и далее доказать правильность сделанного выбора. Игра может быть организована и в виде соревнования, если она проводится фронтально и при этом будет провозглашено правило: "Кто быстрее". Например, в восьмом классе при изучении темы "Обобщение сведений о важнейших классах неорганических соединений" учащиеся получают задание найти "лишнее" в данном ряду вещество по известным вам признакам.
- Al (OH)3, Cu(OH)2, Zn(OH)2, Fe(OH)3, NaOH.
- CO2, Na2O, BaO, CuO, CaO.
- SO2, CaO, MgO, Al2O3, NaCl.
- HCl, H2SO4, HNO3, HBr, HJ.
Для выполнения такого задания учащиеся должны вспомнить и применить знания свойств основных классов неорганических веществ. Составление подобных игр школьниками мы используем и в качестве самостоятельного домашнего задания. При самостоятельном составлении этих заданий учащиеся проявляют творчество: например, предлагают разные варианты оформления заданий. При изучении периодического закона Д.И.Менделеева в 8 классе можно использовать настольную игру “Химическое лото”. Для игры надо иметь три ватманских листа бумаги, разлинованные на квадраты под таблицу Д.И.Менделеева. В квадратах одного листа написать знаки химических элементов (с порядковыми номерами или без них). После этого разрезают лист на квадраты.
Полученные таким образом карточки переворачивают обратной стороной и перемешивают. Второй и третий листы бумаги, разлинованные по контурную таблицу Д.И.Менделеева, оставляют на столе. Ведущий вызывает к столу двух учащихся и каждому предлагается взять по одинаковому количеству карточек. На ознакомление со взятыми карточками он дает 1-2 мин., после чего вызванные учащиеся должны разложить взятые карточки на соответствующие клетки контурных таблиц Д.И.Менделеева. Побеждает тот, кто лучше знает периодическую систему элементов Д.И.Менделеева.
Широкий спектр применения может иметь настольная игра “Крестики-нолики”. Так как общая идея игры заключается в зачеркивании трех клеточек на основании одинаковых обозначений (или крестики или нолики), то игра этого типа подходит для формирования умений сравнивать между собой различные химические вещества или процессы по определенному признаку. В число этих признаков входят одинаковое строение внешнего электронного слоя, одинаковое значение степени окисления центрального атома, одинаковая растворимость веществ в воде, реакции данного вещества с одним и тем же веществом и т.д. Самым элементарным способом игры в “Крестики-нолики” является предоставление учащимся готовых таблиц, где надо указать пути к выигрышу. Для выигрыша в таблице 1 надо найти соединения, азот имеет одинаковые значения степени окисления.
В таблице 2 для выигрыша надо соединить линией формулы тех веществ, с которыми реагирует концентрированная азотная кислота.
В таблице 2 для выигрыша надо соединить линией формулы тех веществ, с которыми реагирует концентрированная кислота.
В таблице 3 выигрышный вариант составляют исходные вещества производства азотной кислоты.
Таким образом, с помощью одной игры “Крестики-нолики” можно повторить разнообразный материал о соединениях азота.
Если учащиеся попарно играют в “Крестики-нолики”, то каждый старается написать формулы веществ, растворимых в воде, по определенному признаку на одной прямой. Один из учащихся, например, пишет формулы веществ, растворимых в воде, другой – формулы веществ, нерастворимых в воде.
В “Крестики-нолики” можно играть и так, что каждый из двух учащихся отбирает по собственному желанию значение степени окисления данного центрального атома и старается написать три формулы на одной прямой. В задание другого написать три формулы на одной прямой. В задание другого ученика входит определение степени окисления центрального атома заданного элемента, которое составлял первый ученик.
Дидактическая цель данной игры состоит в повторении таких опорных знаний и умений:
- Знание химических свойств азотной кислоты.
- Умение составлять уравнения химических реакций.
- Знание степени окисления.
- Умение определять степень окисления у различных элементов в сложном веществе.
- Знание химизма процессов производства азотной кислоты.
Учащимся за работу выборочно можно выставить оценки.
| HNO2 | KNO3 | HNO3 |
| NF3 | N2O3 | NH3 |
| NaNO2 | N2 | NaNO3 |
| I | ||
| Сu(NO3)2 | Ca | CuO |
| S | HCl | NaOH |
| Fe | Ca(OH)2 | Cu |
| II | ||
| NH3 | O2 | H2O |
| NaNO2 | N2 | H2 |
| NO | HNO2 | O3 |
| III | ||
Игра “Составь трехзначное число” может быть организована на индивидуальной и коллективной основах. Перед играющими ставится задача обнаружить закономерности в построении и расположении содержания таблицы, состоящей из трех строк и трех колонок, каждая из которых несет определенную информацию.
В первой колонке каждая строка обозначена цифрами 1, 2, 3, во второй, соответственно – 4, 5, 6, в третьей – 7, 8, 9.
Если ученик сумеет обнаружить связь между строками таблицы, он разгадает тайну ее построения и без труда назовет три трехзначных числа. Изменяя содержание таблицы, можно использовать эту игру для других тем курса или для других предметов.
| 1. KCl | 4. CuO | 7. HBr | 1. NaOH | 4. HNO3 | 7. KOH | |
| 2. H2SO4 | 5. HNO3 | 8. KClO3 | 2. H2SO4 | 5. Cu(OH)2 | 8. AgOH | |
| 3. CO2 | 6. NaCl | 9. N2O5 | 3. Zn(OH)2 | 6. Ba(OH)2 | 9. H3PO4 |
| 1. CO2 | 4. K2O | 7. KOH | 1. HCl | 4. Zn(OH)2 | 7. Ba(OH)2 | |
| 2. NaOH | 5. Cu(OH)2 | 8. P2O5 | 2. KOH | 5. HNO3 | 8. HJ | |
| 3. Na2O | 6. SO2 | 9. CuO | 3. H2SO4 | 6. HBr | 9. H3PO4 |
| 1. NaCl | 4. Ba(OH)2 | 7. Fe(OH)3 | 1. KCl | 4. K3PO4 | 7. Na2SO4 | |
| 2. Cu(OH)2 | 5. BaSO4 | 8. FeCl3 | 2. Na3PO4 | 5. K2SO4 | 8. Ba3(PO4)2 | |
| 3. KOH | 6. Zn(OH)2 | 9. NaOH | 3. BaSO4 | 6. BaCl2 | 9. NaCl |
Правила игры “Химическое домино”.
- Количество фишек то же, что и в обычной игре – 28 шт.
H+ H+ NH4+ Cl- F- NO3- OH- Ag+ K+ Ba2+ Ca2+ Mg2+ Al3+ Cr3+ OH- H+ NH4+ Cl- F- NO3- OH- Ag+ Br- SO42- PO43- S2- SO32- SO42-
Fe3+ Fe2+ Zn2+ Cu2+ Fe2+ Zn2+ Cu2+ Cr3+ Ba2+ Ca2+ Mg2+ Na+ Al3+ Fe3+ CO32- SiO32- PO43- PO43- PO43- PO43- S2- SiO32- CO32- SO42- SO32- Na+ PO43- SO42- - Количество очков проигравшего партнера в игре соответствует сумме положительных и отрицательных зарядов.
- Все правила игры с фишкой ноль-ноль сохраняются для
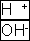 , а шесть – шесть для
, а шесть – шесть для 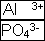
- Кроме того:
- в процессе игры к “катиону” (“катионам”) ставится “анион” (“анионы”) и наоборот, таким образом, чтобы сумма положительных зарядов соответствовала сумме отрицательных;
- если игрок поставил “катион” к “катиону” или “анион” к “аниону”, то происходит “замыкание” и партнер выбывает из игры;
- первым игру начинает партнер, имеющий
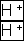 или любой однозарядный “катион”-“катион” или “анион”-“анион”, например:
или любой однозарядный “катион”-“катион” или “анион”-“анион”, например: 



При закреплении навыков написания уравнений в ионной форме, понятия амфотерности учитываются следующие три правила:
- В первой партии – “получивший” практически нерастворимое в воде вещество имеет право на повторный ход.
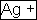
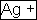


- Во второй партии – “получивший” растворимое в воде вещество имеет право на повторный ход. Например:

- В третьей партии – “получивший” амфотерный гидроксид имеет право на повторный ход. Например:

Второй вариант игры химическое домино помогает углубить знания о химических реакциях между простыми веществами, связывая качественную и количественную стороны химических реакций. Такая игра содействует формированию умению проводить химические расчеты. Игра включает 20 карточек. На каждой из них написаны названия двух простых веществ и их масса. Карточки наклеиваем на картон и вырезаем.
|
1 |
Цинк |
Хлор |
11 |
Алюминий |
Кислород |
|
2 |
Сера |
Медь |
12 |
Магний |
Водород |
|
3 |
Кислород |
Кальций |
13 |
Сера |
Кислород |
|
4 |
Кислород |
Водород |
14 |
Кислород |
Медь |
|
5 |
Железо |
Хлор |
15 |
Калий |
Кислород |
|
6 |
Водород |
Алюминий |
16 |
Натрий |
Кислород |
|
7 |
Кислород |
Сера |
17 |
Углерод |
Кислород |
|
8 |
Магний |
Хлор |
18 |
Кальций |
Кислород |
|
9 |
Хлор |
Углерод |
19 |
Сера |
Хлор |
|
10 |
Кислород |
Хлор |
20 |
Свинец |
Железо |
В игре могут участвовать два, три, четыре, или больше учащихся. Пусть первый учащийся (участник игры) положил на стол карточку, на которой написано: “кислород 32 г и хлор 35,5 г”. Его партнеры должны найти такие карточки, на которых написано название вещества, реагирующего или с кислородом или с хлором. При этом следует учесть и отношение масс реагирующих веществ. Например: с 32 г кислорода реагирует 32 г серы, а с 35,5 г хлора реагирует 23 г натрия и т.д.
Итак, настольные игры занимают часть учебного времени на уроке. Но впоследствии, настольные тренировочные игры мы использовали как отдельные этапы уроков-соревнований, общественных смотров знаний, КВНов и др.
Остановимся на организационных принципах урока - общественный смотр знаний по теме: "Вода. Растворы. Основания".
Уроки общественного смотра знаний (ОСЗ) носят характер состязания. Они нацеливают учеников на серьезное изучение материала в целом, обобщение и систематизацию сведений, формируют познавательный интерес к химии, позволяют разнообразить формы учета знаний. Уроки этого типа - стремление к открытости и сотворчеству. Это своеобразная проверка знаний учащихся, которая организуется с целью показать общественности- родителям , классному руководителю, студентам, учителям химии из других школ - чего достигли школьники в теории и практике предмета.
Рассмотрим пример ОСЗ по теме: “Вода. Растворы. Основания”.
ОСЗ проводится в три этапа:
- Подготовительный.
- Проведение осмотра.
- Заключительный.
На подготовительном этапе учитель продумывает тему и цели ОСЗ, его место в учебной теме изучаемого курса, готовит вопросы и задания участникам смотра, продумывает состав групп учащихся, готовит материально-техническое оснащение игры, продумывает систему оценки.
Чтобы определить место ОСЗ в изучаемой теме рассмотрим блок-тему “Вода. Растворы. Основания”.
| Тема "Вода. Растворы. Основания" |
||||
| Уроки | ||||
| Вводная лекция | Комбинированные уроки | Текущая лекция | Практическая работа | ОСЗ |
В начале изучаемой темы учащимся сообщается о том, что контроль знаний по данной теме будет осуществляться на общественном смотре знаний. Обычно класс делится на 6 групп, которые получают домашнее задание: подготовить тематическую газету и реферат.
Примерные темы рефератов.
- Организм и вода.
- Вода и серебро.
- Вода на планете Земля.
- Вода и минеральные соли.
- Вода, которую мы пьем.
- Способы очистки воды.
Этап - проведение общественного смотра знаний.
План урока
|
Виды работ |
Время, мин. |
1. Организационный момент 2. Химический диктант 3. б) Задание по классификации веществ 4. Решение кроссворда 5. Химическая викторина 6. Демонстрация занимательных химических опытов 7. Подведение итогов и оценка домашнего задания |
2 7 12 6 8 5 5 |
В начале урока учитель создает определенный эмоциональный настрой, стараясь вовлечь в игру всех учащихся, объясняет порядок проведения игры и систему оценки.
После краткого выступления учитель объясняет о предстоящей работе по первому заданию - химический диктант, включает магнитофон, на ленте которого записан текст диктанта. Каждый вопрос в магнитофонной записи повторяется дважды, чтобы учащиеся успели вникнуть в содержание задания.
Примерное содержание вопросов химического диктанта
- Напишите формулу воды.
- Какой буквой обозначают массовую долю растворенного вещества? Как она называется?
- Запишите формулу для расчета массовой доли растворенного вещества.
- Запишите формулу растворимости веществ.
- В каких единицах измеряется растворимость веществ?
- Какая из природных вод самая чистая?
- К каким явлениям (физическим или химическим) относится растворение веществ?
- Запишите химическое уравнение анализа и синтеза воды.
Химический диктант предназначен для проверки знания химических формул и свойств веществ, а также знания расчетных формул. Для выполнения экспериментального задания приглашаются по одному ученику от каждой команды, им выдается карточка с заданием на расчет и приготовление раствора с определенной массовой долей растворенного вещества.
Примерное содержание экспериментальных заданий:
- Приготовьте 100 мл 2% раствора поваренной соли в воде.
- Приготовьте 200 мл 0,5% раствора медного купороса.
В это же время все остальные ученики выполняют задание по классификации веществ на специальных карточках-бланках.
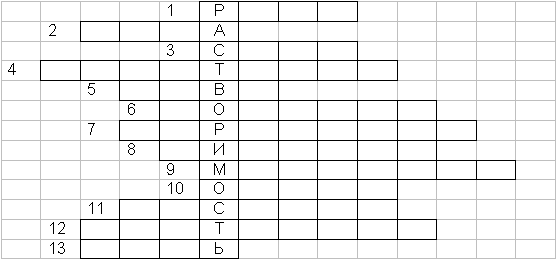
Вопросы к кроссворду (по горизонтали)
- Во что превращаются пары воды при холодных утренниках летом.
- Оксид водорода.
- Вода в твердом состоянии в природе.
- Как называются все подземные воды?
- Латинское название воды.
- Элемент, входящий в состав воды.
- Способ очистки воды.
- Класс химических соединений.
- Мельчайшая частица вещества, обладающая его химическими свойствами.
- Какой буквой обозначают массовую долю растворенного вещества?
- Смесь, состоящая из растворенного вещества и растворителя.
- Отношение массы вещества к объему.
- Соединение, состоящее из атомов металла и кислотного остатка (м-б название хим. класса веществ).
Пока жюри подводит итоги, ребятам демонстрируются химические опыты с помощью графопроектора.
Опыт - 1. Растворимость веществ в воде.
На стекло кадоскопа ставят чашку Петри с водой. В воду помещают несколько кристалликов. Вода вокруг кристаллов окрашивается в фиолетовый цвет, что говорит о процессе растворения-проникновения молекул растворенного вещества молекулами растворителя.
Опыт - 2. Взаимодействие натрия с водой.
В чашечку Петри с водой помещаем небольшой кусочек металлического натрия. В результате выделения большого количества теплоты при реакции, кусочек натрия оплавляется и в виде небольшой капельки бегает по поверхности воды, подталкиваемый выделяющимся водородом. Если к воде добавить фенолфталеин, то за натрием будет оставаться дорожка малиновой окраски, что свидетельствует об образовании щелочи в результате реакции. Все эти явления ребята видят на экране, они очень наглядны и вызывают большой интерес у учащихся.
Задание по классификации веществ.
Распределите вещества по классам, дайте названия веществ.
СО2, КОН, НСl, Н2SО4, NаОН, SiО2 , NaСl,
СuO, Сu(OН)2, НNO3, СuSO4, Р2О5, NaNO3,
Zп(OН)2, Н3РО4, Na2O, Al(OН)3, СаСl2.
|
Оксиды |
Кислоты |
Основания |
Соли |
В конце урока ребятам предлагается химическая викторина.
Вопросы викторины
- Как установить состав воды в лабораторных условиях?
- Каково греческое название воды?
- Каково латинское название воды?
- Кем и когда был установлен истинный состав воды как сложного вещества?
- Сколько % от всей массы человеческого тела составляет вода?
- Почему воды не горит?
- Как называется смесь двух объемов водорода и одного объема кислорода?
- Назовите известные вам технические устройства по очистке и доставке воды для питья.
- Для чего воду хлорируют?
- Как изменяется объем воды при замерзании?
- Какие жидкости практически не растворяются в воде?
Успех урока зависит от четкой работы жюри. В него входит председатель - второй учитель химии и шесть девятиклассников. Члены жюри должны за 1 урок оценить всех учащихся класса по шести заданиям и, подведя итог, поставить оценки игрокам. Поэтому мы добиваемся того, чтобы члены жюри сами отлично разобрались в материале.
По ходу игры члены жюри заполняют сводные карточки учета знаний.
Сводная карточка учета знаний учащихся
|
Ф.И. |
Задания |
Итоги |
||||
|
Диктант |
Эксперем. работа |
Кроссворд |
Задание по классиф. веществ |
Общее число баллов |
Оценка |
|
3-й этап смотра - заключительный, на котором учитель подводит итоги, определяет с помощью жюри командное первенство, учитывая подготовленные тематические газеты и рефераты.
Завершается смотр на определенном эмоциональном подъеме, что достаточно высокий воспитательный эффект.
Смотр - это праздник знаний. Игра, которая проводится для того, чтобы заинтересовать ребят, привить им вкус к изучению химии.